一、药品不良反应监测工作进展
2013年,国家食品药品监督管理总局按照《国家药品安全“十二五”规划》和《药品不良反应报告和监测管理办法》的相关规定,组织做好药品不良反应监测,相关工作取得新进展。
监测体系进一步健全,覆盖面持续扩大。2013年,基层药品不良反应监测机构建设得到进一步加强,药品不良反应报告县级覆盖率达到93.8%。全国每百万人口平均报告数量达到983份,高于世界卫生组织的推荐数量,表明我国发现和收集药品不良反应信息的能力大幅增强。
信息化水平进一步提升,安全预警机制更加成熟。加强监测系统的信息化建设,国家药品不良反应监测系统功能实现了实时数据分析和药品风险预警管理,建立了国家和省两级信息共享、高效联动的不良反应/事件预警机制,药品安全紧急事件的发现和处置能力进一步提高。2013年共组织调查61条预警信息,实现了药品安全事件早发现、早控制。
分析评价能力进一步增强,风险管理水平得到提高。2013年,重点加强基本药物、中药注射剂、生物制品等品种的安全评价。针对监测系统提示的安全性问题,对细辛脑注射液、养血生发胶囊、曲美他嗪、头孢唑林等近50个(类)品种进行了评价,并采取了相应的风险管理和沟通措施,防控药品安全风险。启动“定期安全性更新报告”的评价工作,督促指导药品生产企业做好产品风险管理工作。
风险沟通渠道进一步拓宽,社会参与度更加广泛。定期发布药品不良反应信息通报、药物警戒快讯等,提示临床工作者和公众关注用药安全。加强宣传培训和风险沟通,及时回应社会关注的热点药品安全性事件,答疑释惑,推动安全合理用药意识和水平提高。强化监督检查,推动落实药品生产企业在药品安全中的主体责任。完善药品不良反应文献监测机制,加大与研究机构、协会组织等的合作,药品安全信息收集渠道不断丰富。
二、药品不良反应/事件报告情况
(一)报告总体情况
2013年全国药品不良反应监测网络收到《药品不良反应/事件报告表》131.7万份,较2012年增长了9.0%。其中新的和严重药品不良反应/事件报告29.1万份,占同期报告总数的22.1%。1999年至2013年,全国药品不良反应监测网络累计收到《药品不良反应/事件报告表》近660万份。
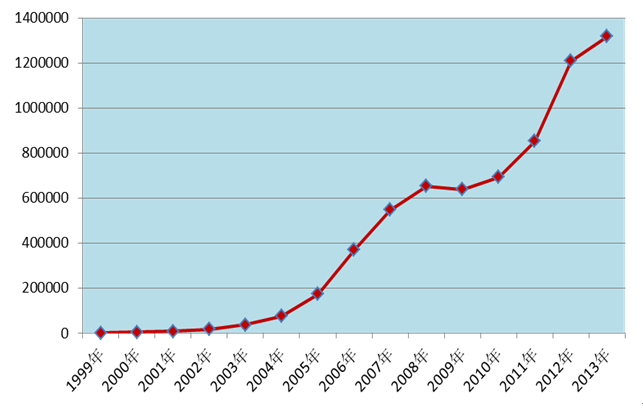
图1 1999-2013年全国药品不良反应/事件报告数量增长趋势
按报告涉及患者年龄统计,14岁以下儿童的报告占10.6%,与2012年基本一致,65岁以上老年人的报告占17.8%,较2012年升高了1.4个百分点。
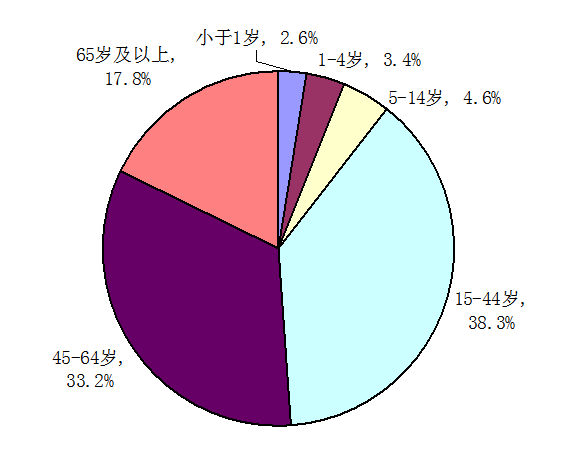
图2 2013年药品不良反应/事件报告年龄分布
按报告来源统计,医疗机构的报告占78.4%、药品经营企业的报告占19.6%、药品生产企业的报告占1.4 %、个人及其他来源的报告占0.6%。与2012年相比,药品生产企业报告数量增长率最高,但整体报告数量仍偏低,经营企业报告数量略有回落。
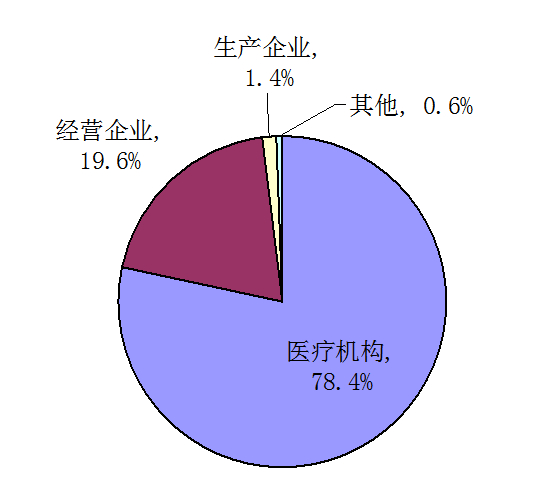
图3 2013年药品不良反应/事件报告来源分布
按药品类别统计,2013年药品不良反应/事件报告涉及的怀疑药品,化学药占81.3%、中药占17.3%、生物制品占1.4%。抗感染药报告数量仍居首位,占化学药的47.6%,较2012年降低1.2个百分点,报告比例已连续4年呈下降趋势。心血管系统用药占化学药的10%,较2013年上升0.4个百分点,且连续4年呈上升趋势。
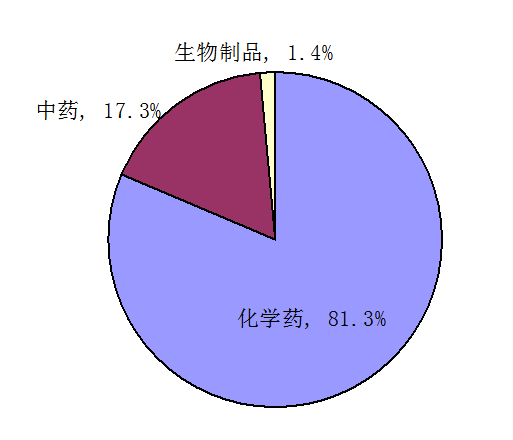
图4 2013年药品不良反应/事件报告涉及药品类别分布
按药品剂型统计,2013年药品不良反应/事件报告涉及的药品剂型分布中,注射剂占58.7%、口服制剂占37.3%、其他制剂占4.0%。注射剂的比例再次出现上升,与2012年相比升高了2个百分点,口服制剂比例降低0.8个百分点。
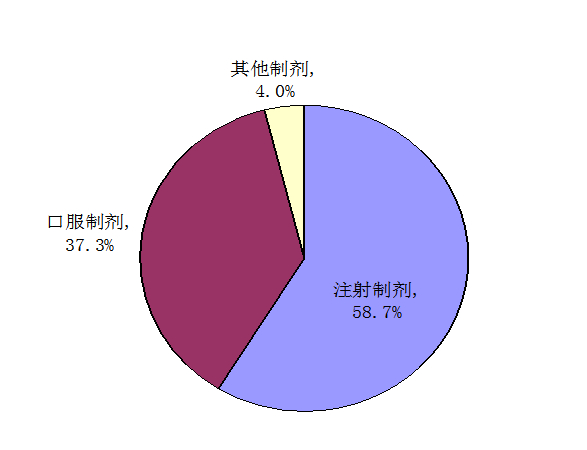
图5 2013年药品不良反应/事件报告涉及药品剂型分布
2013年在医疗机构、药品生产企业、经营企业等多方参与和共同努力下,全国药品不良反应/事件报告数量继续保持增长趋势(图1)。其中药品生产企业报告比例已连续多年呈上升趋势(图6),报告意识不断增强。老年患者的不良反应报告比例有所升高,且已连续几年出现增高态势,提示应关注老年患者的用药安全;注射剂的比例在连续几年下降或持平后又出现反弹,提示相关部门应建立注射剂风险管理的长效机制。2013年在药品监管部门的努力下,报告质量继续提高,严重报告数量较2012年增加22.5%,严重报告所占比例(4.3%)较2012年增加了0.5个百分点。严重不良反应/事件为衡量报告质量的重要指标之一。
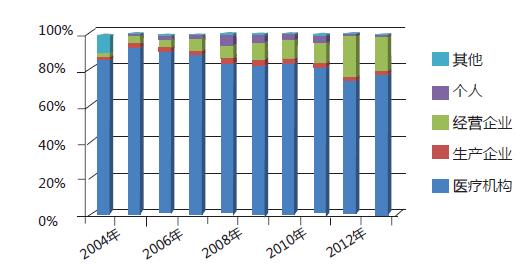
图6 2004-2013年药品不良反应/事件报告不同来源比例
(二)抗感染药监测情况
2013年全国药品不良反应监测网络共收到抗感染药物的不良反应/事件报告51.7万例,其中严重报告2万余例,占4.0%。随着2013年全国药品不良反应/事件病例报告数的整体增长,抗感染药物的报告总数、严重报告数较2012年有所升高,分别增长6.6%和14.3%,增长率均低于总体报告的增长率。
从药品剂型分析,2013年抗感染药物不良反应/事件报告中,注射剂占74.3%、口服制剂占23.2%、其他剂型占2.5%。抗感染药中注射剂比例较总体报告中注射剂比例高出14.5个百分点。
2013年抗感染药物严重报告中排名前五位的类别是:头孢菌素类、青霉素类、喹诺酮类、抗结核病药和β-内酰胺酶抑制药,与2012年基本一致。严重报告数量排名前十位的品种为:头孢曲松、左氧氟沙星、头孢哌酮舒巴坦、青霉素G、头孢呋辛、头孢噻肟、克林霉素、阿奇霉素、利福平和阿洛西林。
抗感染药的不良反应/事件报告数量一直居各类药物之首,是国家药品不良反应监测工作关注的重点。近几年,抗感染药的不良反应报告比例出现持续地小幅下降趋势,说明我国对抗感染药的风险控制取得一定的实效。但头孢类、青霉素类、喹诺酮类药物,因易导致药物过敏等不良反应,加之临床用量大、不合理用药因素的影响,不良反应报告数量居高不下。建议临床医生按照《抗菌药物临床应用指导原则》,合理使用抗感染药,加强不良反应监测和救治,降低使用风险。
(三)中药注射剂监测情况
2013年全国药品不良反应监测网络共收到中药注射剂报告12.1万例次,其中严重报告占5.6%。与2012年相比,中药注射剂报告数量增长17.0%,高于总体报告增长率;严重报告数量增长22.3%,与总体严重报告增长率基本持平。
2013年中药注射剂严重不良反应/事件报告前十位的药品为:清开灵注射剂、参麦注射剂、丹参注射剂、双黄连注射剂、香丹注射剂、血塞通注射剂、脉络宁注射剂、舒血宁注射剂、生脉注射剂和黄芪注射液。
总体上看,2013年中药注射剂安全状况平稳。中药注射剂与其他药品联合使用现象依然存在,可能增加安全风险,临床应谨慎使用。部分中药注射剂涉及的基层医疗卫生机构报告数量比例较大,提示基层使用此类药品可能存在较高风险。
(四)基本药物监测情况
2013年全国药品不良反应监测网络共收到国家基本药物的不良反应/事件报告53.0万例,其中严重报告2.6万例,占4.9%。
国家基本药物不良反应/事件报告中,化学药品和生物制品报告数量排名前五位的均为抗微生物药,分别是左氧氟沙星、头孢曲松、头孢呋辛、青霉素和头孢唑林。中成药注射剂排名前五位的品种分别是:清开灵注射液、参麦注射液、血塞通注射液、注射用血塞通(冻干)和丹参注射液;中成药口服制剂排名前五位的品种分别是:鼻炎康片、双黄连合剂(口服液、颗粒、胶囊、片)、复方丹参片(颗粒、胶囊、滴丸)、六味地黄丸(颗粒、胶囊)和黄连上清丸(颗粒、胶囊、片)。
配合《国家基本药物目录》(2012年版)的发布实施,国家食品药品监督管理总局调整了基本药物不良反应监测平台,开展了对新目录品种的监测工作,并加大对基本药物的预警监测力度。总体上看,2013年国家基本药物安全状况继续保持平稳态势。
三、用药安全提示
(一)老年患者不良反应报告比例逐年上升,应关注老年人用药安全
2009至2013年药品不良反应/事件报告的年龄分布显示,65岁以上老年患者的不良反应报告比例已连续4年呈现小幅升高态势(图7)。一些药品的严重不良反应报告中,老年患者所占比例较大。例如治疗痛风药别嘌醇片,65岁以上老年患者占严重病例报告总人群的45.1%。
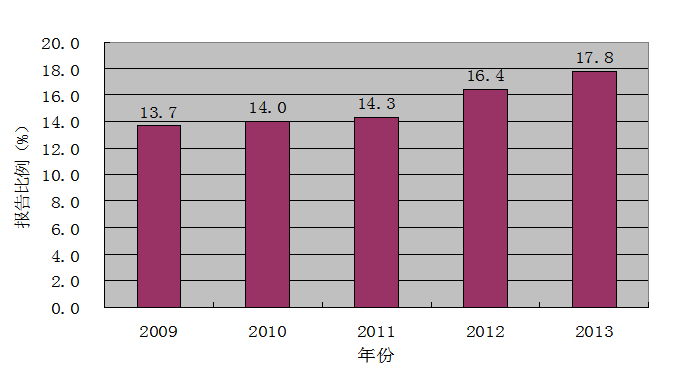
图7 2009-2013年65岁以上老年患者不良反应报告比率
老年人在生理、心理方面均处于衰退状态,给用药安全带来隐患。在生理方面,老年人肝肾功能退化,药物吸收、分布、代谢和排泄均受影响,不良反应发生率升高;老年人往往身患数病,经常多种药物同时使用,容易发生药物相互作用。在心理方面,老年患者安全用药常识相对缺乏,自我风险管理能力较弱;很多老年患者求医心切、用药依从性较差,容易出现不合理用药情况。
我国已步入人口老龄化社会,老年人用药安全问题日益突出,需要社会各界关心、关注老年人健康,共同努力减少药物损害、药源性疾病给老年人带来的健康威胁。
| 小贴士:老年患者如何合理使用抗菌药? 抗菌药物在人体吸收以后,多由肝肾解毒、排泄,因此,肝肾功能不全的老年人在使用抗菌药时需慎重,不宜长期或大剂量应用。四环素类抗生素和磺胺类药物长期服用会损害肝细胞,并伴有对骨髓、心脏、肾脏及皮肤的损害。链霉素、卡那霉素、庆大霉素使用时间稍长,能引起眩晕、耳鸣、耳聋、平衡失调,对肾脏也有影响。使用氯霉素可能引起再生障碍性贫血。红霉素、呋喃妥因等可能在肝胆内瘀积,产生中毒和过敏反应。 |
(二)中药注射剂合并用药现象突出,应警惕药物的相互作用
合并用药可能引起药物的相互作用。国家食品药品监督管理总局发布的《2011年国家药品不良反应监测年度报告》己对中药注射剂合并用药现象进行过分析,提醒合并用药可能会加大中药注射剂的安全风险。但就2013年中药注射剂不良反应报告数据分析来看,合并用药现象并未得到有效缓解。
通过对2013 年中药注射剂不良反应/事件报告数量排名前20 位的药品合并用药情况进行分析,其总体报告涉及合并用药的占41.0%,严重报告涉及合并用药的占54.1%。
建议临床医生根据《中药注射剂临床使用基本原则》的要求,单独使用中药注射剂,禁忌与其他药品配伍使用,谨慎联合用药,如确需联合使用其他药品,应考虑与中药注射剂的间隔时间以及相互作用等问题。
| 小贴士:什么是药物相互作用,哪些药物容易出现相互作用? 药物相互作用是指两种或多种药物合用或先后序贯给药而引起的药物作用和效应的变化。如阿司匹林与氯吡格雷联用可增加出血的风险;克拉霉素与地高辛合用,可引起地高辛中毒。治疗窗范围窄的药物(即剂量稍有变化药理作用即有明显改变的药物)、需要监测血药浓度的药物、酶诱导剂和酶抑制剂都容易发生药物相互作用,包括口服抗凝药、口服降糖药、抗生素类、抗癫痫药、抗心律失常药、强心苷和抗过敏药等。 |
(三)不合理用药增加药品安全风险,医务人员和患者应加强安全用药意识
2013年药品不良反应/事件报告显示,不合理用药现象仍然突出。以尼美舒利为例,因其严重肝损害风险,2011年5月原国家食品药品监督管理局发布通知,规定尼美舒利禁用于12岁以下儿童,适应症限制在抗炎、镇痛的二线治疗,且疗程不超过15天。但尼美舒利的不良反应监测数据分析显示,12岁以下儿童的报告仍占9.8%,用于感冒、发热类疾病的报告占35%,治疗时间超过15天的报告占1.4%。
不合理使用药物,不仅可影响药物的治疗作用,更会加大药物的使用风险。建议医务人员和患者加强安全用药意识,掌握必要的安全用药知识,避免超适应症、超剂量、超疗程用药,严禁禁忌证用药,谨慎联合用药,防止发生药物相互作用。药品的已知不良反应、安全性信息、使用注意事项均记录在药品说明书中,建议患者用药前认真阅读,按说明书规定用药,必要时与医生沟通,为自身健康负责,把好用药关。
| 小贴士:如何正确阅读药品说明书? 药品说明书包含了对药品各方面的介绍,患者服用前应该认真地阅读,按照说明书规定用药。有关药品使用方面,应认真阅读说明书中的【适应症】或【功能主治】、【禁忌】、【用法用量】、【注意事项】;有关药品的安全性方面,应阅读警示语(位于说明书最上方)、【不良反应】、【药物相互作用】等。老年人如需调整用药剂量,会在【注意事项】或【老年人用药】部分进行提示,儿童用药的安全性、孕妇或哺乳期妇女用药会对胎儿或婴儿产生的影响,会在【儿童用药】、【妊娠及哺乳期妇女用药】部分进行提示。为防止相同成份叠加使用导致药物过量,还应详细了解说明书中药品的【成份】,因为不同名称的药品可能含有相同药物成份。药品说明书中的不良反应均为临床研究或上市后监测发现的已知不良反应,一些罕见的、新的不良反应不一定会记录在说明书中,因此患者如果出现疑似不良反应症状,应及时去医院就诊。 |
四、相关风险控制措施
根据2013年药品不良反应监测数据和评估结果,国家食品药品监督管理总局对发现存在安全隐患的药品及时采取相应管理措施,以保障公众用药安全。
(一)发布《药品不良反应信息通报》7期,通报了碘普罗胺注射液、红花注射液、珍菊降压片、别嘌醇片、氟喹诺酮类药品、复方青黛丸(胶丸、胶囊、片)、质子泵抑制剂和左氧氟沙星注射剂等的严重不良反应,对用药安全风险进行提示。
(二)发布《药物警戒快讯》12期,报道了卡马西平严重皮肤反应、托伐普坦肝损害和他汀类降脂药血糖异常等国外药品安全信息70条。
(三)根据监测评价结果,发布了甲磺酸瑞波西汀制剂、西酞普兰制剂、珍菊降压片和黄芪注射液等22个(类)药品的修订说明书通知。
(四)基于对药品效益和风险的全面评估,停止了丁咯地尔、甲丙氨酯制剂的生产、销售和使用,并撤销批准证明文件。
(五)针对监测中发现的风险信号,实施企业约谈机制,组织召开企业沟通会,要求企业开展相关风险管理工作。对监测中发现存在安全隐患的药品,督促企业查找原因、及时整改,可能造成严重影响及不良后果的,要求企业主动召回产品。
五、有关说明
(一)本年度报告中的数据来源于国家药品不良反应监测网络中2013年1月1日至2013年12月31日各地区上报的数据。
(二)与大多数国家一样,我国药品不良反应监测网络收集的数据存在局限性,如漏报、填写不规范、缺乏详细信息、无法计算不良反应发生率等。
(三)本年度报告完成时,其中一些严重报告、死亡报告尚在调查和评价的过程中,所有统计结果均为数据收集情况的真实反映,有些问题并不代表最终的评价结果。
(四)每种药品不良反应/事件报告的数量受到该药品的使用量和该药品不良反应发生率等诸多因素的影响,故药品不良反应/事件报告数量的排名仅是报告数据多少的直接反映,不代表不良反应发生率的高低。
(五)本年度报告不包含疫苗不良反应/事件的监测数据。
| 小贴士:美国、欧洲国家如何发布药品不良反应信息? 美国食品药品管理局(FDA)和欧洲药品监管部门如果在上市后药品监测、研究过程中发现了新的或严重的药品不良反应,会组织本部门或外部专家,对药品的各类相关资料进行审查,开展评估工作。对认为可能影响公众用药安全的问题,将在其网站、刊物或通过其他途径发布相关安全性信息,同时要求企业面向医务人员和患者沟通信息,美国、欧洲国家发布不良反应信息的过程与我国基本一致。我国药品不良反应监测中心对这些信息实施24小时监测,必要时对药品开展评价工作,并提出符合我国国情的监管措施。 |








