7月14日,由广东省药品监督管理局指导,广东省药品监督管理局审评认证中心主办的“春雨行动——推进医疗器械临床研究成果转化”政策宣贯培训班在广州举办。 
聚焦医疗器械临床研究成果转化工作,省科技厅、省知识产权保护中心、省药品监管局审评认证中心分别进行相关科技、专利、医疗器械审评检查政策宣贯,并邀请科研机构、医疗机构代表进行经验分享,共同探讨如何加强医疗器械成果筛选与转化早期服务,落实“春雨行动”,加速创新医疗器械研发与产业化进程。
广东省药品监督管理局党组书记、局长梁勤儒介绍,近年来,广东省在药品、医疗器械和化妆品生产企业数量、注册备案品种存量、创新产品获批数量等方面位居全国前列。截至2025年6月底,全省药械化生产企业总量8983家,注册备案产品达176万余个,均居全国第一。梁勤儒表示,广东高水平医疗机构相对集聚,全省现有三甲医院250家,高水平医院50家,拥有呼吸内科、肾病、传染病、消化内科、肿瘤、中医等一批国内高水平临床试验研究平台,临床试验资源居全国前列。截至2025年6月底,广东省已备案医疗器械临床试验机构174家,近3年来每年新增本省医疗器械临床试验项目超过500个,数量均位居全国第一。 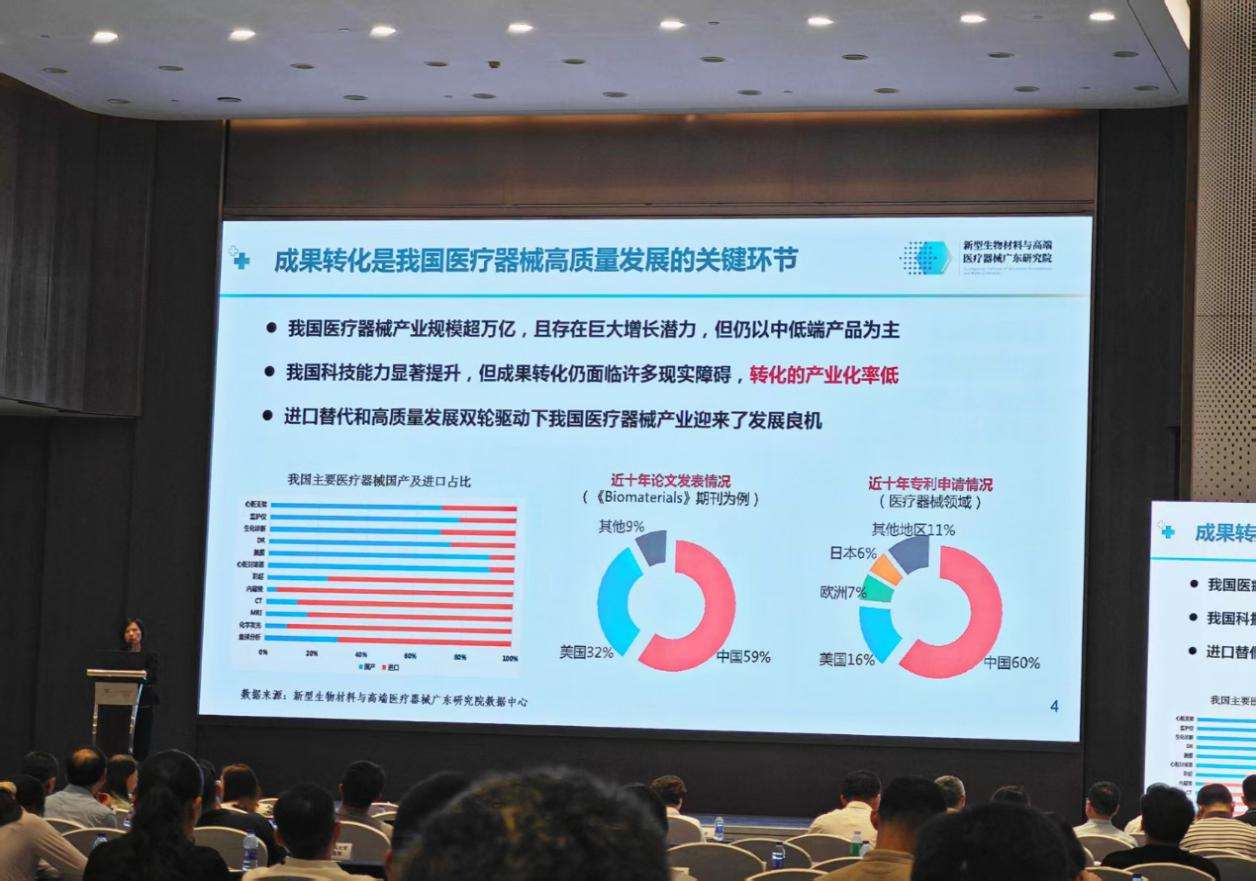
“春雨行动”是由国家药监局主导、促进医疗器械源头创新成果转化的重要举措,通过系统收集临床医生的创新创意,有效对接医疗器械研发需求,搭建从临床研发到使用跨部门全链条协同通道,有效促进医疗器械科研成果转化落地。
广东高度重视“春雨行动——推进医疗器械临床研究成果转化”工作,制定《关于开展春雨行动——推进医疗器械临床研究成果转化工作的实施方案》,以“四个一”推进工作:明确一个目标方案、制定临床价值筛选评价标准、建立项目收集筛选机制、搭建广东临床转化平台。
同时,广东省药品监管局审评认证中心针对成果转化过程中遇到的难点和障碍,按照“提前介入、一企一策、全程指导、研审联动”原则,开展项目培育、辅导和服务。对于符合条件的二类医疗器械项目,推荐其进入审评前置程序、广东第二类医疗器械注册“零发补、少发补”程序,通过研审联动、滚动审评,提升审评效率,缩短注册申报周期,加速上市进程。对于第三类医疗器械项目,引导其申报创新医疗器械特别审查,积极争取国家药监局医疗器械技术审评中心和国家药监局医疗器械审评检查大湾区分中心提供支持,重点培育创新性强、临床价值高的第三类医疗器械,加速产品上市进程。
在培训和分享环节,国家药监局医疗器械技术审评检查大湾区分中心、学会组织、高校代表、医疗机构代表从研发培育服务、品种筛选、转化早期服务和转化案例等进行全面分享交流,探索多方协调发力,形成“医、学、研、产、管”五位一体的工作机制,共同推动广东医疗器械临床研究成果转化工作落地开花结果。








